Гост серная кислота статус
ГОСТ 4204-77
(СТ СЭВ 3856-82)
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Reagents. Sulphuric аcid. Specifications
ОКП 26 1212 0021 05
Дата введения 1978-07-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
В.Г.Брудзь, И.Л.Ротенберг (руководитель темы), Л.Я.Мазо, З.А.Жукова, Л.В.Кидиярова, О.С.Рыженкова, Н.П.Никонова, Т.Г.Манова
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 17.06.77 N 1513
3. Периодичность проверки — 5 лет
4. Стандарт содержит все требования СТ СЭВ 3856-82
5. В стандарт введен международный стандарт ИСО 6353-2-83 (Р.37)
7. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка
Номер пункта, подпункта
3.3.1; 3.5.3.1; 3.6.1.1; 3.6.2.1; 3.6.3.1
3.5.1; 3.5.3.1; 3.6.1.1; 3.6.2.1; 3.11.1
3.3.1; 3.5.3.1; 3.6.1.1; 3.6.2.1; 3.6.3.1; 3.11.1; 3.12.1
3.3.1; 3.5.1; 3.5.3.1; 3.6.2.1; 3.6.3.1; 3.11.1; 3.13.1
8. Ограничение срока действия снято по решению Межгосударственного Совета по стандартизации, метрологии и сертификации (протокол 5-94)
9. ПЕРЕИЗДАНИЕ (октябрь 1994 г.) с Изменениями N 1, 2, утвержденными в феврале 1984 г., июне 1990 г. (ИУС 6-84, 9-90)
ВНЕСЕНА поправка, опубликованная в ИУС N 1, 2014 год
Поправка внесена изготовителем базы данных
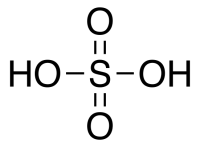
Настоящий стандарт распространяется на реактив — серную кислоту, которая представляет собой бесцветную, прозрачную, маслянистую жидкость, без запаха, без осадка смешивается с водой (при сильном разогревании) и со спиртом.
Молекулярная масса (по международным атомным массам 1971 г.) — 98,08.
Плотность около 1,83 г/см.
(Измененная редакция, Изм. N 1, 2).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1. Серная кислота должна быть изготовлена в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
1.2. По физико-химическим показателям серная кислота должна соответствовать требованиям и нормам, указанным и таблице.
химически чистый
(х.ч.)
ОКП 26 1212 0023 02
чистый для анализа
(ч.д.а.)
ОКП 26 1212 0022 03
чистый
(ч.)
ОКП 26 1212 0021 04
Анализ проводят по п.3.2
2. Массовая доля серной кислоты (НSO), %
3. Массовая доля остатка после прокаливания, %, не более
4. Массовая доля хлоридов (Сl), %, не более
5. Массовая доля нитратов (NО), %, не более
6. Массовая доля аммонийных солей (NH), %, не более
7. Массовая доля тяжелых металлов (Рb), %, не более
8. Массовая доля железа (Fe), %, не более
9. Массовая доля мышьяка (As), %, не более
10. Массовая доля селена (Se), %, не более
11. Массовая доля веществ, восстанавливающих КМnО, % (в пересчете на SO), не более
Примечание. Серную кислоту с нормами, указанными в скобках, допускается выпускать до 01.01.95.
(Измененная редакция, Изм. N 1, 2).
(Поправка. ИУС N 1-2014).
1.3. Серная кислота квалификации "химически чистый" и "чистый для анализа", предназначаемая для анализа этилового спирта, должна выдерживать пробу Савалля по п.3.13.
1.4. Допускается серная кислота в других концентрациях при условии соответствия остальным требованиям настоящего стандарта.
1.5. Допускается изготовителю периодически определять (1 раз в месяц) массовую долю хлоридов, нитратов, тяжелых металлов, мышьяка и селена в серной кислоте, изготовляемой из природной и газовой серы (по ГОСТ 127-76).
1.4 и 1.5. (Введены дополнительно, Изм. N 2).
2. ПРАВИЛА ПРИЕМКИ
2.1. Правила приемки — по ГОСТ 3885-73.
2.2. Пробы из крупногабаритной тары (цистерны, контейнеры), используемой по согласованию изготовителя с потребителем, отбирают пробоотборником, изготовленным из фторопласта.
Источник
Серная кислота ГОСТ 2184-2013 — массовая доля моногидрата H2SO4 в пределах 92,3 — 94%; — плотность 1,824 – 1,831 т/м3; — в холодное время года (с 1 ноября по 15 апреля) концентрация серной кислоты должна быть не менее 92,4% и не более 94%.
Серная кислота ГОСТ 2184-2013 — массовая доля моногидрата H2SO4 в пределах 92,3 — 94%; — плотность 1,824 – 1,831 т/м3; — в холодное время года (с 1 ноября по 15 апреля) концентрация серной кислоты должна быть не менее 92,4% и не более 94%.
Ускоренная регистрация за 1 час!
Срок рассмотрения документов для регистрации на ЭТП ГПБ,по регламенту площадки, составляет пять рабочих дней.
Документация процедуры
Сведения об организаторе
Наименование организатора Организатор
ПУБЛИЧНОЕ АКЦИОНЕРНОЕ ОБЩЕСТВО ИЖСТАЛЬ
Все закупки и тендеры ПАО ИЖСТАЛЬ
426006, Российская Федерация, Удмуртская Республика, Ижевск, Новоажимова, 6
426006, Российская Федерация, Удмуртская Республика, Ижевск, Новоажимова, 6
Адрес электронной почты
Ф.И.О. контактного лица
Рылова Анастасия Владиславовна
Место рассмотрения предложений
Комплекс бизнес услуг для поставщика в финансовом супермаркете ЭТП ГПБ!
www.etpfs.ru +7 800 100 66 20 info@etpfs.ru
Список лотов
Кислота серная техническая ГОСТ 2184-2013 — массовая доля моногидрата H2SO4 в пределах 92,3 — 94%; — плотность 1,824 – 1,831 т/м3; — в холодное время года (с 1 ноября по 15 апреля) концентрация серной кислоты должна быть не менее 92,4% и не более 94%.
Этапы закупочной процедуры
Дата подведения итогов
Цена договора и требования к обеспечению
Кислота серная техническая ГОСТ 2184-2013 — массовая доля моногидрата H2SO4 в пределах 92,3 — 94%; — плотность 1,824 – 1,831 т/м3; — в холодное время года (с 1 ноября по 15 апреля) концентрация серной кислоты должна быть не менее 92,4% и не более 94%.
Цена не указана
Размер обеспечения заявки (в рублях)
Для заключения контракта предоставьте банковскую гарантию
* Если это является обязательным условием
Получите банковскую гарантию с помощью сервиса ЭТП ГПБ
Количество поставляемого товара/объем выполняемых работ/оказываемых услуг
Кислота серная техническая 240 тонн (ежемесячно 60 т)
Место поставки товаров/выполнения работ/оказания услуг
426006, г. Ижевск, ул. Новоажимова, 6Рассчитать логистику >
Условия оплаты и поставки товаров/выполнения работ/оказания услуг
Требования к электронной подписи поставщиков
Подавать заявки без использования ЭП
Требования к документации
Официальный сайт, на котором размещена документация
426006, Российская Федерация, Удмуртская Республика, Ижевск, Новоажимова, 6
Источник
Серная кислота ХЧ ГОСТ 4204 77
Внешний вид: бесцветная, прозрачная, маслянистая жидкость, без запаха, без осадка смешивается с водой (при сильном разогревании) и со спиртом.
Спецификация согласно ГОСТ 4204-77:
Анализ проводят по п.3.2
Массовая доля серной кислоты (Н 2 SO 4 )
Массовая доля остатка после прокаливания, не более
Массовая доля хлоридов (Сl), не более
Массовая доля нитратов (NО 3 ), не более
Массовая доля аммонийных солей (NH 4 ), не более
Массовая доля тяжелых металлов (Рb), не более
Массовая доля железа (Fe), не более
Массовая доля мышьяка (As), не более
Массовая доля селена (Se), не более
Массовая доля веществ, восстанавливающих КMnО 4 (в пересчете на SO 2 ), не более
Класс опасности: 2
Гарантийный срок хранения: 3 года со дня изготовления
Условия хранения: препарат хранят в крытых складских помещениях.
Серная кислота (хч)
Внешний вид: бесцветная, прозрачная, маслянистая жидкость, без запаха, без осадка смешивается с водой (при сильном разогревании) и со спиртом.
Спецификация согласно ГОСТ 4204-77:
Анализ проводят по п.3.2
Массовая доля серной кислоты (Н 2 SO 4 )
Массовая доля остатка после прокаливания, не более
Массовая доля хлоридов (Сl), не более
Массовая доля нитратов (NО 3 ), не более
Массовая доля аммонийных солей (NH 4 ), не более
Массовая доля тяжелых металлов (Рb), не более
Массовая доля железа (Fe), не более
Массовая доля мышьяка (As), не более
Массовая доля селена (Se), не более
Массовая доля веществ, восстанавливающих КMnО 4 (в пересчете на SO 2 ), не более
Класс опасности: 2
Гарантийный срок хранения: 3 года со дня изготовления
Условия хранения: препарат хранят в крытых складских помещениях.
Страна происхождения: РОССИЯ, РОССИЯ.
Модификации Серная кислота (хч)
Персональные рекомендации
Хотите, чтобы доставку Вашего заказа организовали мы?
- Если Вы находитесь в г. Уфе, мы пришлём к Вам нашего курьера. Стоимость доставки – от 300 руб. (в зависимости от веса и габаритов заказа).
- В другие регионы страны мы доставим приобретённый Вами товар ТК "Деловые линии" или Почтой России. Стоимость доставки рассчитывается исходя из параметров Вашего заказа и будет автоматически включена в счёт.
Предварительно оценить стоимость доставки "Деловыми линиями" Вы можете здесь, воспользовавшись калькулятором транспортной компании.
В нашем Интернет-магазине цены на химическую продукцию указаны за фасовку и с НДС.
В данный момент оплатить свою покупку на нашем сайте Вы можете только с помощью банковского перевода и путём 100 % предоплаты.
Заказ считается оплаченным только при перечислении его полной стоимости на расчётный счёт магазина.
Частичная оплата заказа в нашем интернет-магазине не предусмотрена. В случае неполучения 100 % оплаты заказа в течение 72 часов после выставления счёта, товар будет снят с резерва.
Источник
Серная кислота ГОСТ 4204-77
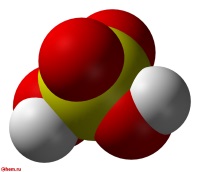
Серная кислота H 2 SO 4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).
Содержание
- 1 Название
- 2 Получение серной кислоты
- 2.1 Промышленный (контактный) способ
- 2.2 Нитрозный (башенный) способ
- 2.3 Другой способ
- 3.1 Олеум
Название
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом», очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Получение серной кислоты
Промышленный (контактный) способ
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
Другой способ
В тех редких случаях, когда сероводород (H2S) вытесняет сульфат(SO4 — ) из соли (с металлами Cu,Ag,Pb,Hg) побочным продуктом является серная кислота
Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным чёрным окрасом,
но могут быть окислены до сульфатов, например, азотной кислотой при кипении:
CuS + 8HNO3 → CuSO4 + 8NO2↑ + 4H2O
Физические и физико-химические свойства
Очень сильная кислота, при 18 о С pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10 −2 ); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2O с температурой кипения 338,8 о С). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4 − — 0,18, H3SO4 + — 0,14, H3O + — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3O + , HSO3 + , и 2HSO₄ − . Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
Свойства водных растворов серной кислоты и олеума
Содержание % по массе Плотность при 20 ℃, г/см³ Температура плавления, ℃ Температура кипения, ℃ H2SO4 SO3 (свободный) 10 — 1,0661 −5,5 102,0 20 — 1,1394 −19,0 104,4 40 — 1,3028 −65,2 113,9 60 — 1,4983 −25,8 141,8 80 — 1,7272 −3,0 210,2 98 — 1,8365 0,1 332,4 100 — 1,8305 10,4 296,2 104,5 20 1,8968 −11,0 166,6 109 40 1,9611 33,3 100,6 113,5 60 2,0012 7,1 69,8 118,0 80 1,9947 16,9 55,0 122,5 100 1,9203 16,8 44,7 Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
lg p = A − B + 2,126 , T
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
d = 1,851 7 − 1,1 ⋅ 10 −3 t + 2 ⋅ 10 −6 t 2
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
λ = 0,518 + 0,0016t − ( 0,25 + t/1293 ) ⋅ C/100
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T 3/2 см²/с.
Химические свойства
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.
Углерод до CO2, серу — до SO2.
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например:
На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ.
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например:
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например:
Применение
Перевозка серной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернахСерную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- для восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P₂O₅ фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH₄)₂SO₄ серной кислоты 75 % от массы расходуемого (NH₄)₂SO₄. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
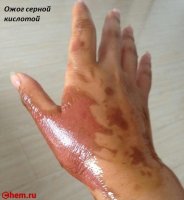
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
В РФ оборот серной кислоты концентрации 45% и более — ограничен.
Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси
В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅10 7 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Источник